Yn gyntaf, strwythur a phriodweddau grisial SiC.
Mae SiC yn gyfansoddyn deuaidd a ffurfiwyd gan elfen Si ac elfen C mewn cymhareb 1: 1, hynny yw, 50% silicon (Si) a 50% carbon (C), a'i uned strwythurol sylfaenol yw tetrahedron SI-C.
Diagram sgematig o strwythur tetrahedron carbid silicon
Er enghraifft, mae atomau Si yn fawr mewn diamedr, yn gyfwerth ag afal, ac mae atomau C yn fach mewn diamedr, yn gyfwerth ag oren, ac mae nifer cyfartal o orennau ac afalau yn cael eu pentyrru at ei gilydd i ffurfio grisial SiC.
Cyfansoddyn deuaidd yw SiC, lle mae bylchiad atom bond Si-Si yn 3.89 A, sut i ddeall y bylchiad hwn? Ar hyn o bryd, mae gan y peiriant lithograffeg mwyaf rhagorol ar y farchnad gywirdeb lithograffeg o 3nm, sef pellter o 30A, ac mae'r cywirdeb lithograffeg 8 gwaith yn fwy na'r pellter atomig.
Egni bond Si-Si yw 310 kJ/mol, felly gallwch ddeall mai'r egni bond yw'r grym sy'n tynnu'r ddau atom hyn oddi wrth ei gilydd, a'r mwyaf yw egni'r bond, y mwyaf yw'r grym sydd ei angen arnoch i dynnu'n ddarnau.
Er enghraifft, mae atomau Si yn fawr mewn diamedr, yn gyfwerth ag afal, ac mae atomau C yn fach mewn diamedr, yn gyfwerth ag oren, ac mae nifer cyfartal o orennau ac afalau yn cael eu pentyrru at ei gilydd i ffurfio grisial SiC.
Cyfansoddyn deuaidd yw SiC, lle mae bylchiad atom bond Si-Si yn 3.89 A, sut i ddeall y bylchiad hwn? Ar hyn o bryd, mae gan y peiriant lithograffeg mwyaf rhagorol ar y farchnad gywirdeb lithograffeg o 3nm, sef pellter o 30A, ac mae'r cywirdeb lithograffeg 8 gwaith yn fwy na'r pellter atomig.
Egni bond Si-Si yw 310 kJ/mol, felly gallwch ddeall mai'r egni bond yw'r grym sy'n tynnu'r ddau atom hyn oddi wrth ei gilydd, a'r mwyaf yw egni'r bond, y mwyaf yw'r grym sydd ei angen arnoch i dynnu'n ddarnau.
Diagram sgematig o strwythur tetrahedron carbid silicon
Er enghraifft, mae atomau Si yn fawr mewn diamedr, yn gyfwerth ag afal, ac mae atomau C yn fach mewn diamedr, yn gyfwerth ag oren, ac mae nifer cyfartal o orennau ac afalau yn cael eu pentyrru at ei gilydd i ffurfio grisial SiC.
Cyfansoddyn deuaidd yw SiC, lle mae bylchiad atom bond Si-Si yn 3.89 A, sut i ddeall y bylchiad hwn? Ar hyn o bryd, mae gan y peiriant lithograffeg mwyaf rhagorol ar y farchnad gywirdeb lithograffeg o 3nm, sef pellter o 30A, ac mae'r cywirdeb lithograffeg 8 gwaith yn fwy na'r pellter atomig.
Egni bond Si-Si yw 310 kJ/mol, felly gallwch ddeall mai'r egni bond yw'r grym sy'n tynnu'r ddau atom hyn oddi wrth ei gilydd, a'r mwyaf yw egni'r bond, y mwyaf yw'r grym sydd ei angen arnoch i dynnu'n ddarnau.
Er enghraifft, mae atomau Si yn fawr mewn diamedr, yn gyfwerth ag afal, ac mae atomau C yn fach mewn diamedr, yn gyfwerth ag oren, ac mae nifer cyfartal o orennau ac afalau yn cael eu pentyrru at ei gilydd i ffurfio grisial SiC.
Cyfansoddyn deuaidd yw SiC, lle mae bylchiad atom bond Si-Si yn 3.89 A, sut i ddeall y bylchiad hwn? Ar hyn o bryd, mae gan y peiriant lithograffeg mwyaf rhagorol ar y farchnad gywirdeb lithograffeg o 3nm, sef pellter o 30A, ac mae'r cywirdeb lithograffeg 8 gwaith yn fwy na'r pellter atomig.
Egni bond Si-Si yw 310 kJ/mol, felly gallwch ddeall mai'r egni bond yw'r grym sy'n tynnu'r ddau atom hyn oddi wrth ei gilydd, a'r mwyaf yw egni'r bond, y mwyaf yw'r grym sydd ei angen arnoch i dynnu'n ddarnau.
Gwyddom fod pob sylwedd yn cynnwys atomau, ac mae strwythur grisial yn drefniant rheolaidd o atomau, a elwir yn orchymyn amrediad hir, fel y canlynol. Gelwir yr uned grisial leiaf yn gell, os yw'r gell yn strwythur ciwbig, fe'i gelwir yn ciwbig llawn clos, ac mae'r gell yn strwythur hecsagonol, fe'i gelwir yn hecsagonol llawn pacio agos.
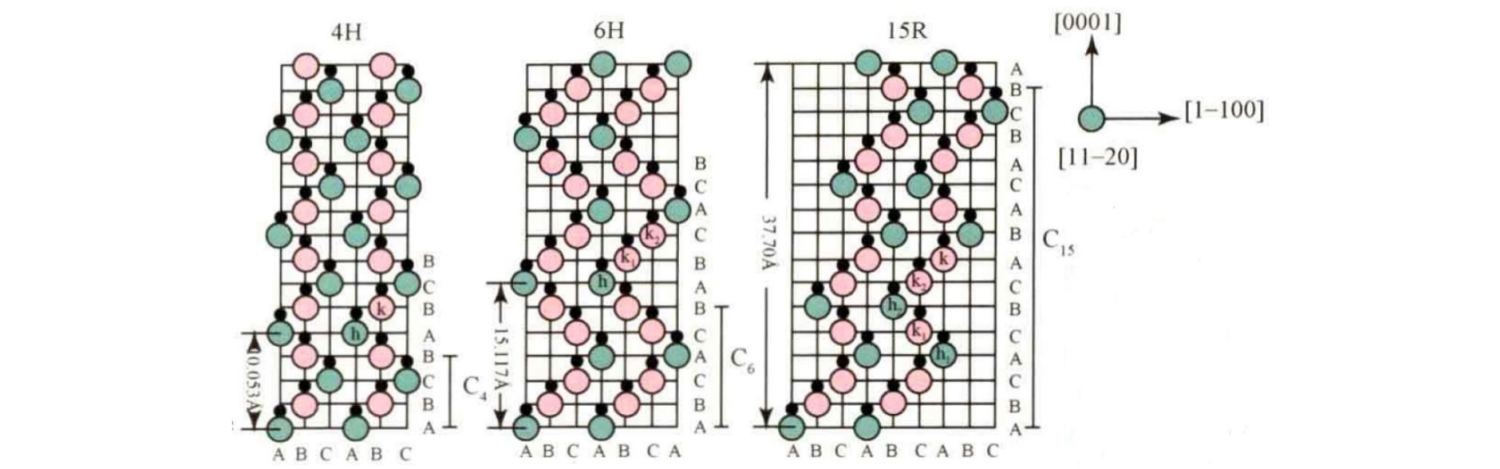
Mae mathau crisial SiC cyffredin yn cynnwys 3C-SiC, 4H-SiC, 6H-SiC, 15R-SiC, ac ati. Dangosir eu dilyniant pentyrru yn y cyfeiriad echelin c yn y ffigur.
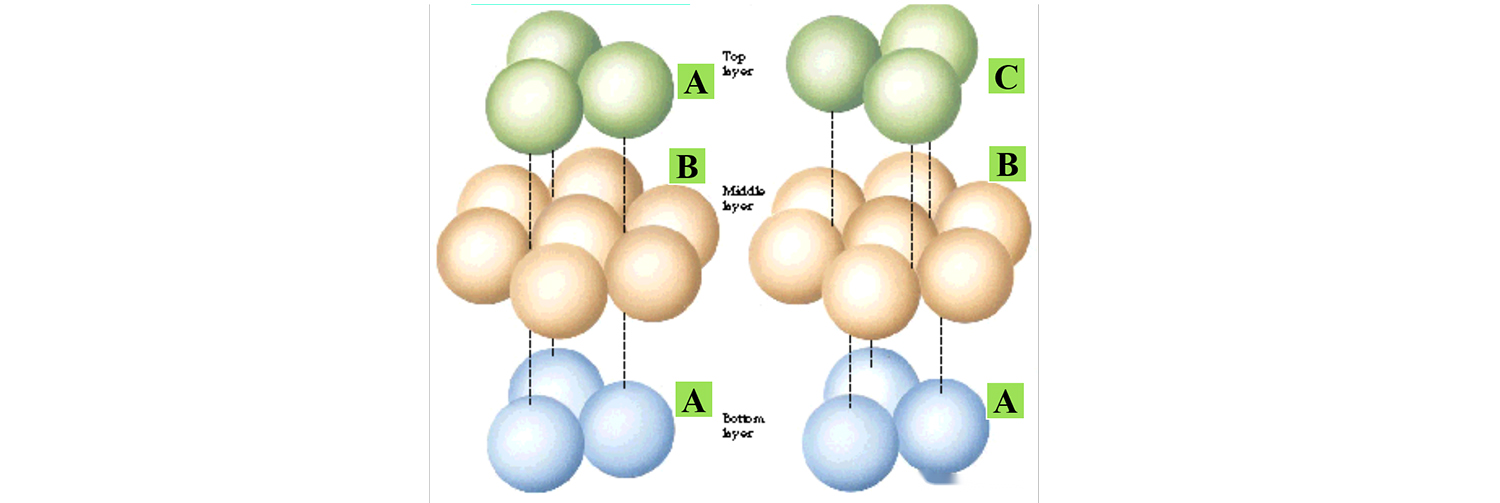
Yn eu plith, y dilyniant stacio sylfaenol o 4H-SiC yw ABCB... ; Y dilyniant stacio sylfaenol o 6H-SiC yw ABCACB... ; Y dilyniant pentyrru sylfaenol o 15R-SiC yw ABCACBCABACABCB... .
Gellir gweld hyn fel brics ar gyfer adeiladu tŷ, mae gan rai o'r brics tai dair ffordd o'u gosod, mae gan rai bedair ffordd o'u gosod, mae gan rai chwe ffordd.
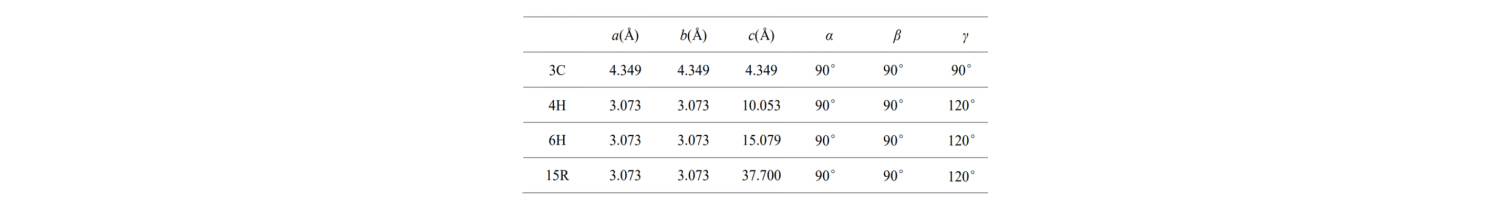
Dangosir paramedrau celloedd sylfaenol y mathau crisial SiC cyffredin hyn yn y tabl:
Beth mae a, b, c ac onglau yn ei olygu? Disgrifir strwythur y gell uned leiaf mewn lled-ddargludydd SiC fel a ganlyn:
Yn achos yr un gell, bydd y strwythur grisial hefyd yn wahanol, mae hyn fel ein bod ni'n prynu'r loteri, y rhif buddugol yw 1, 2, 3, fe brynoch chi 1, 2, 3 tri rhif, ond os yw'r rhif wedi'i ddidoli. yn wahanol, mae'r swm buddugol yn wahanol, felly gellir galw nifer a threfn yr un grisial, yr un grisial.
Mae'r ffigur canlynol yn dangos y ddau ddull stacio nodweddiadol, dim ond y gwahaniaeth yn y modd pentyrru o'r atomau uchaf, mae'r strwythur grisial yn wahanol.
Mae'r strwythur grisial a ffurfiwyd gan SiC yn gysylltiedig yn gryf â thymheredd. O dan weithred tymheredd uchel o 1900 ~ 2000 ℃, bydd 3C-SiC yn trawsnewid yn araf yn polyform SiC hecsagonol fel 6H-SiC oherwydd ei sefydlogrwydd strwythurol gwael. Mae'n union oherwydd y gydberthynas gref rhwng y tebygolrwydd o ffurfio polymorphs SiC a thymheredd, ac ansefydlogrwydd 3C-SiC ei hun, mae cyfradd twf 3C-SiC yn anodd ei wella, ac mae'r paratoad yn anodd. Y system hecsagonol o 4H-SiC a 6H-SiC yw'r rhai mwyaf cyffredin a hawsaf i'w paratoi, ac fe'u hastudir yn eang oherwydd eu nodweddion eu hunain.
Dim ond 1.89A yw hyd bond bond SI-C mewn grisial SiC, ond mae'r egni rhwymo mor uchel â 4.53eV. Felly, mae'r bwlch lefel ynni rhwng y cyflwr bondio a'r cyflwr gwrth-bondio yn fawr iawn, a gellir ffurfio bwlch band eang, sydd sawl gwaith yn fwy na Si a GaAs. Mae lled bwlch y band uwch yn golygu bod y strwythur grisial tymheredd uchel yn sefydlog. Gall yr electroneg pŵer cysylltiedig wireddu nodweddion gweithrediad sefydlog ar dymheredd uchel a strwythur afradu gwres wedi'i symleiddio.
Mae rhwymiad tynn y bond Si-C yn golygu bod gan y dellt amlder dirgryniad uchel, hynny yw, ffonon egni uchel, sy'n golygu bod gan y grisial SiC symudedd electron dirlawn uchel a dargludedd thermol, ac mae gan y dyfeisiau electronig pŵer cysylltiedig a cyflymder newid uwch a dibynadwyedd, sy'n lleihau'r risg o fethiant dyfais gor-dymheredd. Yn ogystal, mae cryfder maes dadelfennu uwch SiC yn caniatáu iddo gyflawni crynodiadau dopio uwch a chael ymwrthedd is.
Yn ail, hanes datblygiad grisial SiC
Ym 1905, darganfu Dr Henri Moissan grisial SiC naturiol yn y crater, a ganfu ei fod yn debyg i ddiemwnt a'i enwi'n ddiamwnt Mosan.
Mewn gwirionedd, mor gynnar â 1885, cafodd Acheson SiC trwy gymysgu golosg â silica a'i gynhesu mewn ffwrnais drydan. Ar y pryd, roedd pobl yn ei gamgymryd am gymysgedd o ddiamwntau a'i alw'n emery.
Ym 1892, gwellodd Acheson y broses synthesis, cymysgodd dywod cwarts, golosg, ychydig bach o sglodion pren a NaCl, a'i gynhesu mewn ffwrnais arc trydan i 2700 ℃, a llwyddodd i gael crisialau SiC cennog. Gelwir y dull hwn o syntheseiddio crisialau SiC yn ddull Acheson a dyma'r dull prif ffrwd o hyd o gynhyrchu sgraffinyddion SiC mewn diwydiant. Oherwydd purdeb isel deunyddiau crai synthetig a phroses synthesis garw, mae dull Acheson yn cynhyrchu mwy o amhureddau SiC, cywirdeb grisial gwael a diamedr crisial bach, sy'n anodd bodloni gofynion y diwydiant lled-ddargludyddion ar gyfer maint mawr, purdeb uchel ac uchel - grisialau o ansawdd, ac ni ellir eu defnyddio i gynhyrchu dyfeisiau electronig.
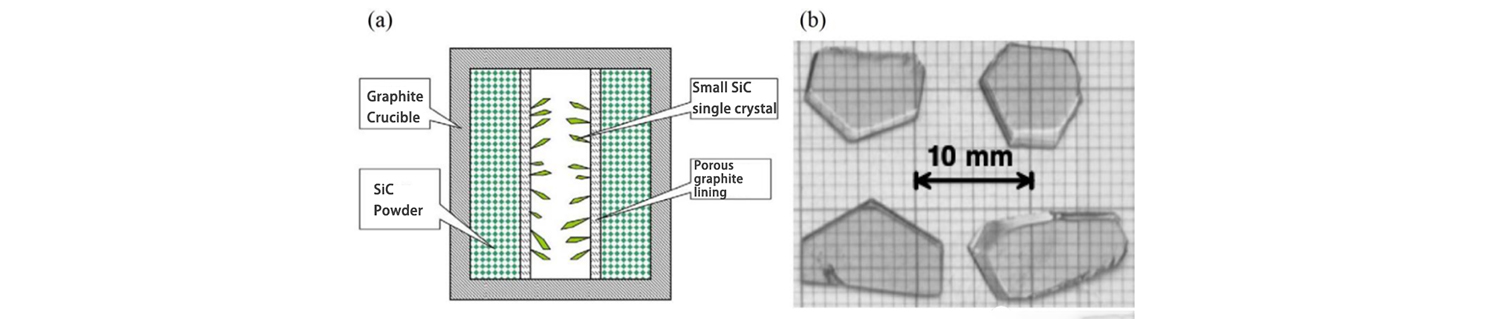
Cynigiodd Lely o Labordy Philips ddull newydd ar gyfer tyfu crisialau sengl SiC ym 1955. Yn y dull hwn, defnyddir crucible graffit fel y llestr twf, defnyddir grisial powdr SiC fel y deunydd crai ar gyfer tyfu grisial SiC, a defnyddir graffit mandyllog i ynysu ardal wag o ganol y deunydd crai sy'n tyfu. Wrth dyfu, caiff y crucible graffit ei gynhesu i 2500 ℃ o dan atmosffer Ar neu H2, ac mae'r powdr SiC ymylol yn cael ei aruchel a'i ddadelfennu i sylweddau cyfnod anwedd Si a C, ac mae'r grisial SiC yn cael ei dyfu yn y rhanbarth gwag canol ar ôl y nwy. mae llif yn cael ei drosglwyddo trwy'r graffit mandyllog.
Yn drydydd, technoleg twf grisial SiC
Mae twf crisial sengl SiC yn anodd oherwydd ei nodweddion ei hun. Mae hyn yn bennaf oherwydd y ffaith nad oes unrhyw gyfnod hylif â chymhareb stoichiometrig o Si: C = 1: 1 ar bwysau atmosfferig, ac ni ellir ei dyfu gan y dulliau twf mwy aeddfed a ddefnyddir gan broses twf prif ffrwd bresennol y lled-ddargludyddion. diwydiant - dull CZ, dull crucible cwympo a dulliau eraill. Yn ôl cyfrifiad damcaniaethol, dim ond pan fydd y pwysedd yn fwy na 10E5atm a'r tymheredd yn uwch na 3200 ℃, gellir cael y gymhareb stoichiometrig o ddatrysiad Si: C = 1: 1. Er mwyn goresgyn y broblem hon, mae gwyddonwyr wedi gwneud ymdrechion di-baid i gynnig gwahanol ddulliau o gael crisialau SiC o ansawdd uchel, maint mawr a rhad. Ar hyn o bryd, y prif ddulliau yw dull PVT, dull cyfnod hylif a dull dyddodiad cemegol anwedd tymheredd uchel.
Amser post: Ionawr-24-2024